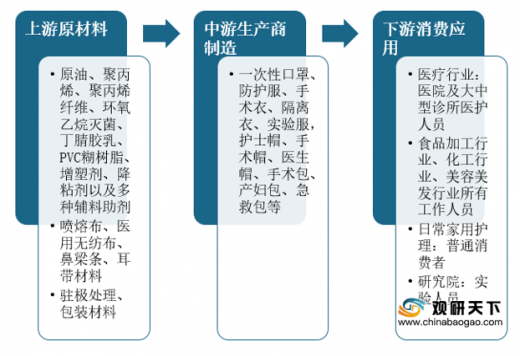
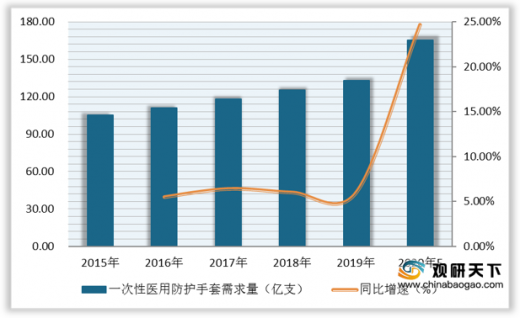
2019年我国一次性医用防护手套需求量为132.71亿支,同比上涨5.98%。由于新冠病毒的爆发,口罩、手套等一次性医用防护产品的需求迅速增加,预计2020年需求达165.44亿支。
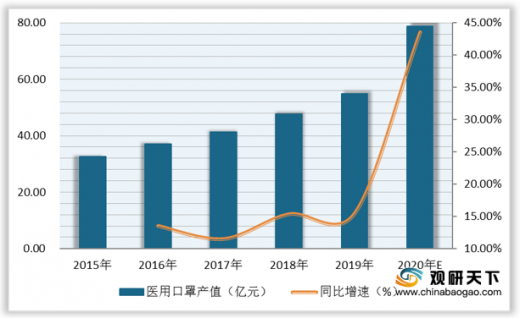
近些年,我国医用口罩产值呈逐年增长趋势,从2015年的32.54亿元增至2019年的54.91亿元,复合增长率为13.97%。
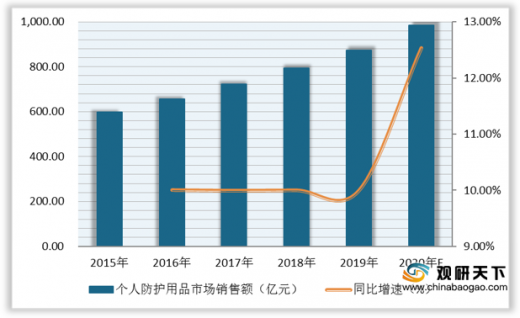
随着人们防护意识的增强,我国个人防护用品市场销售额不断上涨,2019年我国个人防护用品市场销售额为873.7亿元,预计2020年将达983.2亿元。
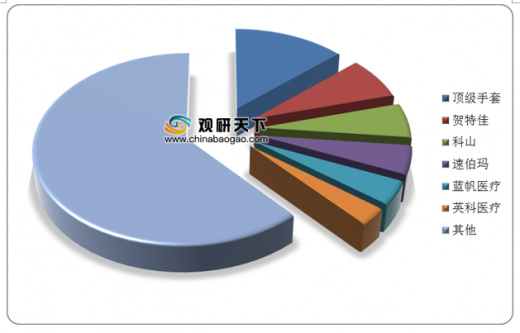
从全球一次性手套行业竞争格局来看,我国手套龙头公司蓝帆医疗和英科医疗分别占全球市场的4%和2.89%,可见自从我国部分PVC手套公司逐渐引入丁腈生产线,产品也不断被全球消费者所接纳。
为了更好的监管医疗器械、一次性医疗防护用品等产品,国家药品监督管理局、国家卫生健康委员会发布了一系列相关政策。
| 企业名称 |
成立年费 |
总部所在地 |
产品/领域 |
| 稳健医疗 |
1991年 |
深圳 |
医疗卫生、个人护理、家庭护理、母婴护理、家纺服饰等多领域 |
| 欣意医疗 |
1997年 |
东莞 |
医用一次性无纺布手术衣、医用一次性无纺布手术包、医用一次性无纺布手术铺单、医用一次性无纺布手术口罩、医用一次性无纺布鞋套、医用一次性无纺布清洁巾及劳保防护用工作服、隔离服、实验服等 |
| 高贝斯医疗 |
2008年 |
合肥 |
医用一次性防护服、医用一次性无纺布手术衣、医用一次性无纺布手术包等 |
| 正德医疗 |
2009年 |
许昌 |
各类一次性手术敷料包、急救包、无纺布制品、高分子材料和特殊敷料 |
| 洁利康医疗 |
2011年 |
平顶山 |
手术包、手术单、手术衣、复合料、防护服、防护罩六大系列产品 |
| 时间 |
政策名称 |
发布机构 |
主要内容 |
| 2018.01 |
医疗器械标准规划(2018—2020年) |
为提高医疗器械标准水平,加强标准实施的监督检查,助推医疗器械创新发展,食品药品监管总局组织制定了《医疗器械标准规划(2018—2020年)》。医疗器械标准是医疗器械研制、生产、经营、使用以及监督管理所遵循的统一技术要求,也是医疗器械产业发展水平的重要标志。 |
|
| 2018.01 |
关于发布用于罕见病防治医疗器械注册审查指导原则的通告(2018年第101号) |
国家药品监督管理局 |
为支持和鼓励罕见病防治相关医疗器械的研发,满足临床所需,规范注册申请人及审查人员对用于罕见病防治医疗器械产品的注册申报和审评审批,以患者受益为中心,科学解决用于罕见病防治医疗器械的临床评价难点,合理减免临床,以附带条件批准方式促进该类产品尽快用于临床。 |
| 2018.08 |
关于印发2018年医疗器械行业标准制修订项目的通知 |
国家药品监督管理局 |
一、组织开展医疗器械行业标准制修订工作,加强制修订工作和经费管理,确保各项工作任务按要求完成。二、在制修订过程中充分了解和掌握所涉及的主要产品情况,做好标准技术内容的验证工作,其中对于修订的标准项目,要明确标准变化的内容,并对标准实施时间和注册等环节提出实施意见建议。三、各相关省(自治区、直辖市)食品药品监督管理局要高度重视,加强对本行政区域标准制修订项目承担单位的监督和管理,督促各相关单位按照标准制修订工作有关要求,完成标准起草、验证、征求意见、技术审查及报批工作。 |
| 2018.09 |
关于公布新修订免于进行临床试验医疗器械目录的通告(2018年第94号) |
国家药品监督管理局 |
为进一步做好医疗器械注册管理工作,国家药品监督管理局组织遴选了新一批免于进行临床试验的医疗器械(含体外诊断试剂)目录。为配合实施新修订的《医疗器械分类目录》,组织对前期已发布的三批免于进行临床试验的医疗器械(含体外诊断试剂)目录进行了修订和汇总。 |
| 2018.11 |
关于发布创新医疗器械特别审查程序的公告(2018年第83号) |
国家药品监督管理局 |
鼓励医疗器械研发创新,促进医疗器械新技术的推广和应用,推动医疗器械产业高质量发展。 |
| 2018.12 |
关于2019年医疗器械行业标准制修订计划项目公示 |
国家药品监督管理局 |
国家药品监督管理局组织开展了2019年医疗器械行业标准制修订项目遴选工作,经公开征求意见和组织专家论证,确定了2019年94项医疗器械行业标准制修订计划项目。 |
| 2019.01 |
《关于做好第一批实施医疗器械唯一标识工作有关事项的通告》 |
国家药品监督管理局 |
《通告》对第一批医疗器械唯一标识实施品种范围、进度安排、工作要求等进行了明确规定。根据《通告》,2020年10月1日起,生产列入首批实施目录的医疗器械,应当具有医疗器械唯一标识。 |
| 2019.07 |
医疗器械唯一标识系统试点工作方案 |
国家药品监督管理局、国家卫生健康委员会 |
建立医疗器械唯一标识系统框架。实现医疗器械唯一标识的创建、赋予以及数据上传下载和共享功能,形成试点品种的医疗器械唯一标识数据库,建立唯一标识数据平台。开展唯一标识在医疗器械生产、经营、流通和使用等各环节的试点应用,形成示范应用标准和规范。探索利用唯一标识实现医疗器械不良事件报告、产品召回及追踪追溯等实施应用。探索医疗器械唯一标识在卫生、医保等领域的衔接应用,实现注册审批、临床应用、医保结算等信息平台的数据共享。 |
| 2019.08 |
医疗器械检验工作规范 |
国家药品监督管理局 |
为加强医疗器械检验工作,提升医疗器械检验机构的检验能力和管理水平,提高医疗器械检验工作质量和效率等 |

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。