2018年,药审中心受理的7336件新注册申请中,化药注册申请受理量在全部注册申请受理量中占比最高,达82%,申请受理量为5979件。
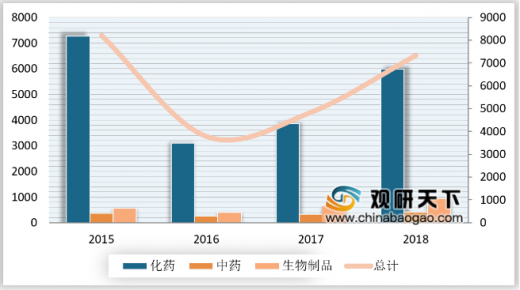
2018年药审中心受理化药注册申请共5979件,其中受理化药NDA申请107件,同比增长了43%;化药ANDA申请982件,同比增长了79%。
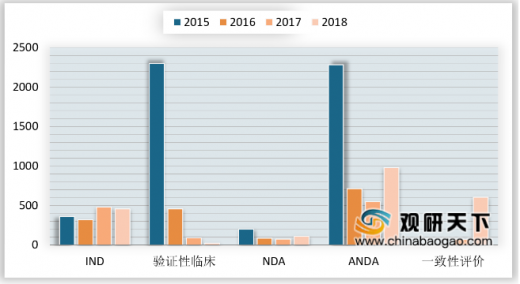
创新药受理方面,2018年受理的157个化药创新药注册申请中,国产化药创新药注册申请为115个品种,较2017年增加3个;进口化药创新药注册申请为42个品种,较2017年增加5个。
2018年药审中心受理化药IND申请457件,其中受理国产化药IND申请325件,受理进口IND申请132件。其中,国产化药IND申请的适应症主要集中在抗肿瘤、内分泌系统和消化系统领域,进口IND申请的适应症主要集中在抗肿瘤、内分泌系统和循环系统领域。
中药注册申请受理情方面,2018年药审中心受理中药注册申请413件,其中受理中药IND申请31件,较2017年减少2件;受理中药NDA 8件,较2017年增加7件;受理中药ANDA 8件,较2017年增加1件。


生物制品注册申请受理方面,2018年药审中心受理生物制品注册申请944件,其中受理生物制品IND申请298件,同比增长17.3%;受理生物制品NDA 85件,同比增长70%。
2018年药审中心受理1类治疗用生物制品IND申请108件(涉及93个品种),适应症主要集中在抗肿瘤治疗领域,占全部1类治疗用生物制品IND申请的70%。
全年审评审批完成情况
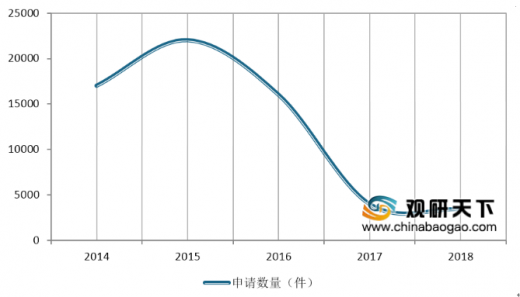
2018年底排队等待审评审批的注册申请已由2015年9月高峰时的近22000件降至3440件(不含完成审评因申报资料缺陷等待申请人回复补充资料的注册申请),进一步巩固了44号文件要求解决注册申请积压的成效。
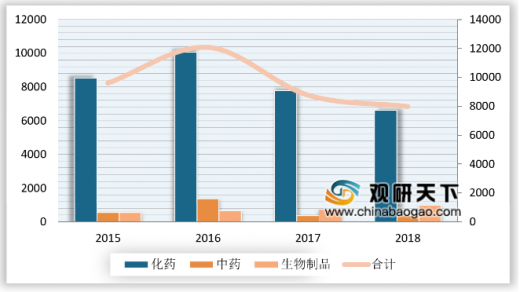
2018年完成审评的申请中,化药注册申请数量占全部审评完成量最多达83%,申请量为6624件,同比下降14.85%。
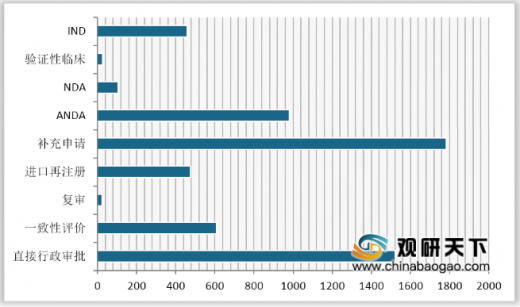
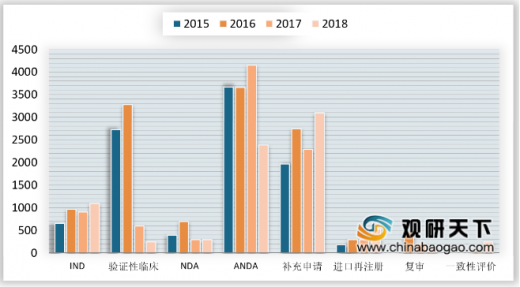
各类注册申请审评完成情况,2018年药审中心完成IND申请审评1094件,同比增长20.49%;完成NDA审评296件,较2017年增加2件;完成ANDA审评2388件,同比下降42.49%。
参考观研天下发布《》
审评通过情况,2018年药审中心审评通过批准IND申请947件,审评通过NDA 175件,审评通过ANDA 1038件,审评通过上市1类创新药9个品种,审评通过进口原研药67个品种。
化药注册申请审评完成方面,2018年药审中心完成审评的化药注册申请6624件,其中完成化药临床申请(IND和验证性临床)共843件,占化药注册申请比重13%;完成化药NDA 206件,占化药注册申请比重3%;完成化药ANDA 2353件,占化药注册申请比重36%。
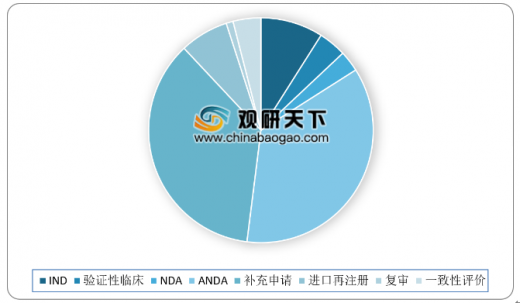
2018年药审中心完成审评的化药NDA 206件,其中审评通过132件,较2017年增加21件。
| 申请类型 |
完成审评情况(件) |
|||
| 审评通过 (含完善资料后通过) |
建议 不批准 |
其他 |
合计 |
|
| IND |
554 |
12 |
37 |
603 |
| 验证性临床 |
130 |
14 |
96 |
240 |
| NDA |
132 |
9 |
65 |
206 |
| ANDA |
1038 |
115 |
1200 |
2353 |
| 补充申请 |
1776 |
127 |
511 |
2414 |
| 进口再注册 |
395 |
27 |
60 |
482 |
| 复审 |
/ |
88 |
||
| 一致性评价 |
/ |
238 |
||
| 合计 |
/ |
6624 |
||
2018年药审中心完成审评的化药IND申请603件,审评通过批准IND申请554件,其中批准1类创新药临床试验申请449件。

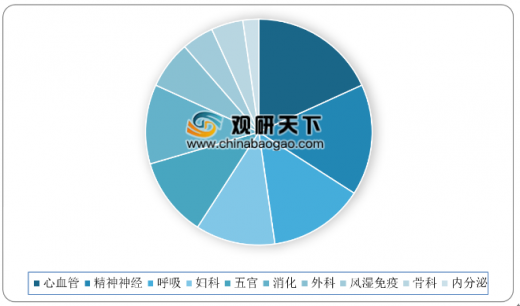
2018年药审中心审评通过批准创新药临床试验的172个品种,较2017年增加2个品种。其中,抗肿瘤药物、消化系统药物、内分泌系统药物和抗感染药物较多,占全部创新药临床试验批准数量的68%。
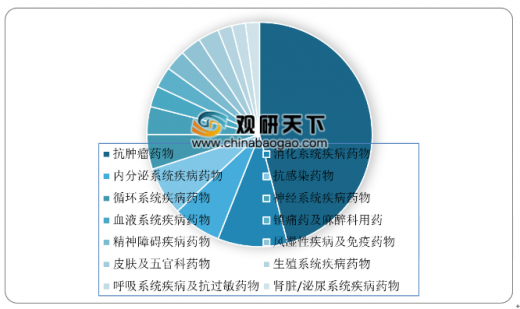
中药注册申请审评完成方面,2018年药审中心完成审评的中药注册申请393件,其中完成IND申请61件,占比为16%;完成NDA 9件,占比为2%;完成ANDA 35件,占比为9%。
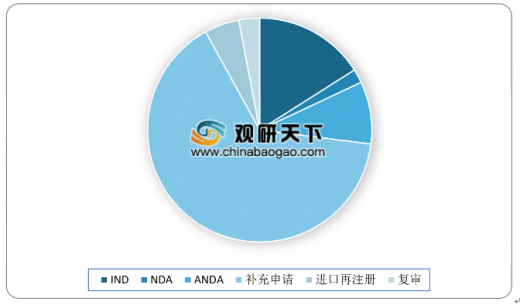
审评通过情况方面,2018年药审中心审评通过批准中药IND申请44件,较2017年增加8件;审评通过中药NDA 2件(涉及2个品种,关黄母颗粒、金蓉颗粒),较2017年增加1件。
| 申请类型 |
完成审评情况(件) |
|||
| 审评通过 (含完善资料后通过) |
建议 不批准 |
其他 |
合计 |
|
| IND |
44 |
4 |
13 |
61 |
| NDA |
2 |
1 |
6 |
9 |
| ANDA |
0 |
3 |
32 |
35 |
| 补充申请 |
139 |
10 |
108 |
237 |
| 进口再注册 |
2 |
8 |
11 |
21 |
| 复审 |
/ |
10 |
||
| 合计 |
/ |
393 |
||
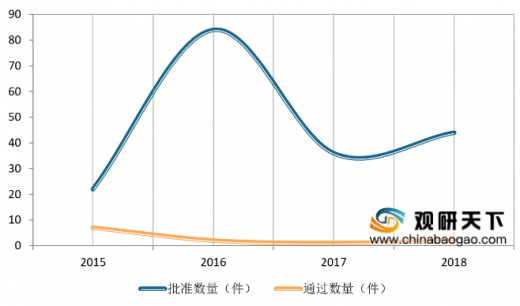
2018年药审中心审评通过批准临床试验的中药IND申请44件,涉及10个适应症领域,其中心血管、精神神经、呼吸较多,共占48%。
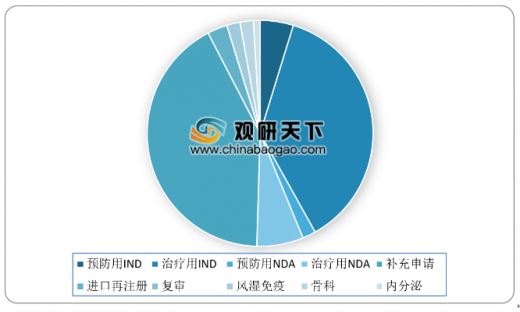
生物制品注册申请审评完成方面,2018年药审中心完成审评的生物制品注册申请共971件,其中完成预防用生物制品IND申请(预防用IND)53件,占比为5%;完成治疗用生物制品IND申请(治疗用IND)377件,占比为39%;完成预防用生物制品NDA(预防用NDA)18件,占比为2%;完成治疗用生物制品NDA(治疗用NDA)63件,占比为7%。
审评通过方面,2018年药审中心审评通过批准预防用IND 33件,批准治疗用IND 316件;审评通过预防用NDA 11件、治疗用NDA 30件。
| 申请类型 |
完成审评情况(件) |
|||
| 审评通过 (含完善资料后通过) |
建议 不批准 |
其他 |
合计 |
|
| 预防用IND |
33 |
3 |
17 |
53 |
| 治疗用IND |
316 |
14 |
47 |
377 |
| 预防用NDA |
11 |
1 |
6 |
18 |
| 治疗用NDA |
30 |
1 |
32 |
63 |
| 补充申请 |
271 |
7 |
146 |
424 |
| 进口再注册 |
23 |
1 |
9 |
33 |
| 复审 |
/ |
3 |
||
| 合计 |
/ |
971 |
||
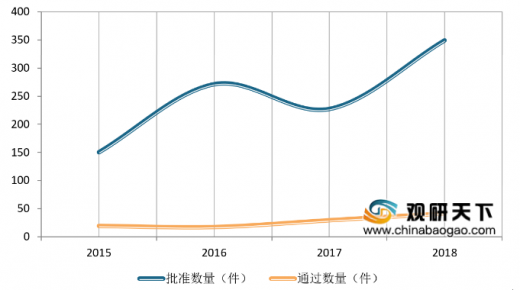
2018年药审中心审评通过批准生物制品IND 349件,其中批准的治疗用生物制品IND治疗涉及十多个领域。

行政审批任务完成情况
2018年,药审中心共完成行政审批任务5860件,其中,完成无需技术审评的直接行政审批任务(即无需技术审评的补充申请)1808件,平均审批时限为12.3个工作日,远小于法定的20日行政审批时限,其中有1656件任务在法定的20日时限内完成,全年平均按时限完成率为92%;完成需技术审评品种的行政审批任务(即临床申请、进口再注册申请、需技术审评的补充申请等)4052件,平均审批时限为18.6个工作日,小于法定的20日行政审批时限,全年平均按时限审批完成率为84%。(注:上述4052件需技术审评的行政审批任务,不包括原辅包关联审评审批实施前已受理完成审评后转原辅包登记平台管理的注册申请任务)。
优先审评纳入情况
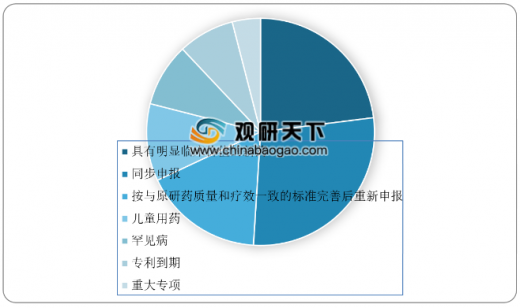
优先审评品种纳方面,2018年药审中心共将313件注册申请纳入优先审评程序,其中,同步申报的品种占比最大,占比为28%,共86件,其次为具有明显临床价值的新药,占比为23%,共72件。
优先审评品种审评完成方面,2018年共有83个品种通过优先审评程序得以加快批准上市(以通用名计算),如自主研发的注射用艾博韦泰、口服丙肝治疗用新药达诺瑞韦钠片、治疗晚期结直肠癌的小分子血管生成抑制剂呋喹替尼胶囊等药品。
沟通交流情况
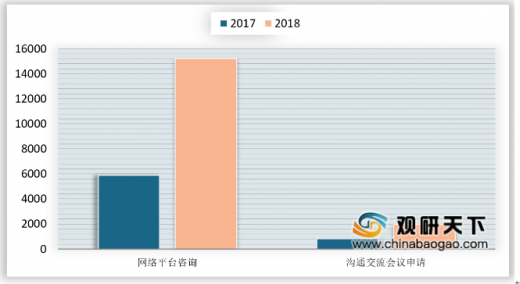
沟通交流方面,2018年药审中心接收沟通交流申请1982件,同比增长136%;接收网络平台咨询15219个,同比增长159%,其中电话咨询超过上万次,邮件咨询数千次,同时每周三定期开展现场咨询。
沟通交流会召开方面,2018年收到沟通交流会议申请1982件,其中Pre-IND会议申请和Pre-NDA会议申请占比例较多,分别为42%和28%,均较2017年申请比例有明显增加。

根据申请人拟沟通的问题及提交的支持性材料,经审核评估,2018年药审中心召开沟通交流会322次,其余均以书面形式进行了答复。
| 沟通交流会议申请 |
申请数量 |
比例 |
召开数量 |
| Pre-IND会议申请 |
824 |
42 |
120 |
| IND会议申请 |
207 |
10 |
31 |
| Ⅰ期后会议申请 |
183 |
9 |
37 |
| Ⅱ期后会议申请 |
213 |
11 |
47 |
| Pre-NDA会议申请 |
555 |
28 |
87 |
| 合计 |
1982 |
- |
322 |


【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。