一、干细胞治疗
干细胞治疗主要包括利用胚胎干细胞或诱导多能干细胞(induced pluripotent stem cells,iPSC)细胞治疗和成体干细胞治疗两大类。胚胎干细胞的临床应用受到伦理限制,而iPSC的临床应用受安全性(致瘤风险)、临床疗效及成本等限制,目前主要以成体干细胞治疗为主。
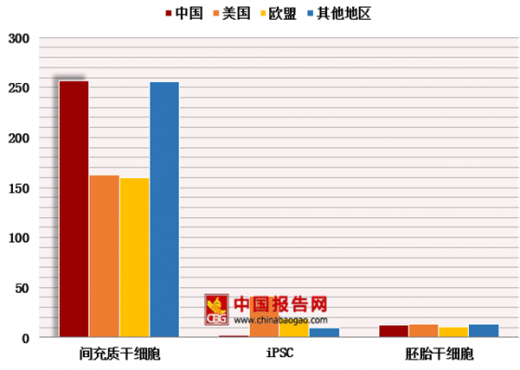
目前,全球干细胞研究是一大热点。截止2018年5月8日,Clinicaltrials.gov查询结果显示,全球间充质干细胞的临床研究共836项,其中中国257项位于全球之首,美国163项,欧盟160项;iPSC的临床研究全球共72项,美国41项,欧盟19项,而中国仅2项;胚胎干细胞的临床研究全球49项,美国13项,中国12项,欧盟11项。
截至目前,全球已有13种干细胞治疗药物获批上市,而我国干细胞临床研究进展较快。
| 获批时间 |
国家 |
商品名 |
公司 |
来源 |
适应证 |
| 2009.01 |
比利时 |
Chondro
Celect |
Tigennix |
自体软骨细胞 |
膝关节软骨缺损 |
| 2009.12 |
美国 |
Prochymal |
Osiris |
异体骨髓 |
Ⅰ型糖尿病骨修复 |
| 2010.07 |
澳大 利亚 |
MPC |
Mesoblast |
自体间质前体 |
急性心肌梗死 |
| 2011.07 |
韩国 |
Hearticellgram-AMI |
FCB-Pharmicell |
自体骨髓MSC |
造血系统、免疫系统疾病需行造血干细胞移植 |
| 2011.11 |
美国 |
Hemacord |
NewYork
Blood Center |
脐带血造血祖细胞 |
复杂性克隆病并发肛瘘 |
| 2012.01 |
韩国 |
Cuepistem |
Anrerogen |
自体脂肪来源MSC |
退行性关节炎、膝关节软骨损伤 |
| 2012.01 |
韩国 |
Cartistem |
Medi-post |
脐带血来源MSC |
儿童急性重症GVHD赫尔勒综合征 |
| 2012.05 |
加拿大 |
Prochymal |
Osiris |
异体骨髓 |
中重度角膜缘干细胞缺陷症(LSCD) |
| 2012.07 |
美国 |
MultiStem |
Athersys |
骨髓等来源多能成体祖细胞 |
GVHD |
| 2015.02 |
欧盟 |
Holoclar |
ChiesiFarmaceutici |
自体角膜上皮 |
Burger病引起的严重性下肢缺血 |
| 2015.09 |
日本 |
Temcell |
Mesoblast |
异体骨髓 |
膝关节软骨损伤 |
| 2016.05 |
印度 |
Stempeucel |
Stempeutics
Research |
异体骨髓 |
膝关节软骨缺损 |
| 2016.12 |
美国 |
Maci |
Vericel |
自体膝盖软骨细胞 |
Ⅰ型糖尿病骨修复 |
| 研究单位 |
研究领域 |
临床进展 |
| 南京大学第一附属医院 |
心脏疾病 |
已经证实自体骨髓MSC能显著改善急性心肌梗死患者的左心室功能;已完成MSC心梗注射液的I期临床试验(SFDA药品评审中心受理号:X0408234) |
| 解放军总医院附属第一医院 |
汗腺再生 |
首次证实输注自体骨髓来源MSC能再生功能性汗腺结构 |
| 解放军第302医院 |
肝脏疾病 |
异体脐带MSC治疗组肝功能改善明显,12周内MELD评分降低,而且长期(80周)生存率提高到约70%(对照组为40%) |
| 中山大学第三附属医院 |
肝脏疾病 |
长期随访结果表明,自体骨髓 MSC 移植对由慢性乙肝病毒引起肝衰竭患者是安全的;短期内有一定的有效性,但长期结果没有得以显著改善;对于存在肝硬化的患者,自体骨髓 MSC 移植能够相对降低发生肝细胞癌的风险和死亡率 |
| 解放军第307医院 |
血液病 |
率先在国际上开展了骨髓MSC应用的临床随机对照试验,并证实骨髓MSC与异基因造血干细胞共移植能显著降低GVHD的发生率脐带来源MSC治疗寻常型银屑病2例报道 |
| 中国医学科学院血液学研究所 |
银屑病糖尿病 |
证实移植自体G-CSF动员的外周血单个核细胞能改善糖尿病患者的严重肢体缺血 |
| 复旦大学附属华山医院福建总医院 |
神经系统肾移植 |
报道利用神经干细胞治疗脑外伤患者的试验结果 |
以上众多领域的专家学者们都在进一步研究干细胞治疗的有效性及安全性,并积极推进多中心临床试验开展,进一步明确其疗效。在间充质干细胞与胚胎干细胞的临床研究中,我国均在数量上遥遥领先;目前,全球仅10项CRISPR基因编辑改造人体细胞的临床试验中,9项来自中国,而在美国仅1项研究获批进入临床试验阶段。中国干细胞治疗的飞速发展,对行业监管提出了更高的要求,以规范行业的建设发展并释放创新活力。
二、以CAR-T为代表的肿瘤免疫细胞治疗
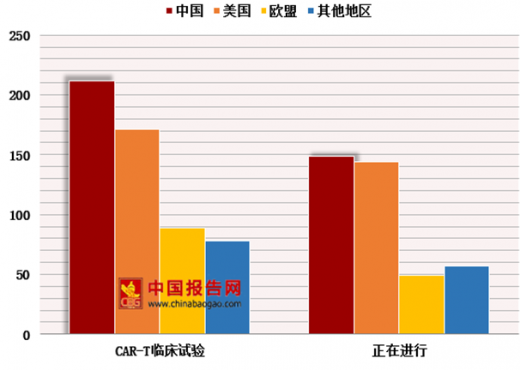
在肿瘤免疫细胞治疗方面,CAR-T在B细胞肿瘤治疗上取得突破性疗效。截止2018年5月8日,全球CAR-T临床试验550项,其中美国212项、中国171项、欧洲89项;正在进行中的全球379项,其中美国144项、中国149项、欧洲49项。临床试验中,以治疗血液肿瘤居多,大多数采用2代CAR-T进行治疗。
参考观研天下发布《2019年中国细胞治疗市场分析报告-行业深度调研与投资前景研究》
三、我国细胞治疗行业的监管
目前,我国细胞治疗行业是由国家卫生健康委员会和国家市场监督管理总局双重管理,即由原卫生和计划生育委员会和国家食品药品监督管理总局共同管理。国家细胞治疗行业监管现状仍迫切需要完善,以适应国内外发展与激烈竞争。虽然政府对我国细胞治疗发展明确支持,但主要问题还是缺乏明确的管理模式及指导原则。因此,需要结合国际主流监管模式与我国行业自身特点,制定符合中国细胞治疗发展的行业规范及要求。
| 发布时间 |
政策内容 |
| 1994年4月 |
《人基因治疗申报临床试验指导原则》出台 |
| 2003年 |
国家药品监督管理局发布了《人体细胞治疗研究和制剂质量控制技术指导原则》,明确了质量评价指标 |
| 2009年3月 |
卫生部制定印发《医疗技术临床应用管理办法》,规定国家建立医疗技术临床应用准入和管理制度,对医疗技术实行分类、分级管理 |
| 2009年5月 |
发布《首批允许临床应用的第三类医疗技术目录》,规定“自体免疫细胞(T 细胞、NK细胞)治疗技术”按第三类技术管理 |
| 2012年 |
《生物产业发展规划》(国发[2012]65号)将细胞治疗、基因治疗列为重要发展和重点支持产业 |
| 2015年6月 |
颁布关于印发《干细胞临床研究管理办法(试行)》的通知 |
| 2015年7月2日 |
国家卫计委发出通知,取消第三类医疗技术临床应用准入审批,2009年发布的《首批允许临床应用的第三类医疗技术目录》同时废止 |
| 2016年5月4日 |
随着“魏则西事件”的发酵,国家卫生计生委紧急全面叫停细胞免疫治疗的临床应用 |
截至目前,根据《干细胞临床研究管理办法(试行)》(国卫科教发〔2015〕48号),原国家卫生计生委和食品药品监管总局已组织对申报干细胞临床研究机构备案材料进行复核,先后两批共102家机构符合干细胞临床研究的要求已进行备案。根据要求,军委后勤保障部卫生局研究审核,也确定了军内12所医院为首批备案的军队医院干细胞临床研究机构。该举意味着干细胞领域的临床研究进一步规范化,“未熟先热”的行业现状成为过去。
近年来,由于细胞治疗在我国的迅猛发展,迫切需要形成更加有序、规范、成熟的产业链,为了贯彻基础研究、临床研究以及产业化要求,故各地方主管部门及行业协会出台相关政策及规定也愈加频繁。
| 发布时间 |
政策内容 |
| 2015年2月 |
深圳市市场监督管理局出台 《人类间充质干细胞库建设与管理规范》 |
| 2016年10月 |
中国医药生物技术协会 《免疫细胞制剂制备质量管理自律规范》 |
| 2016年10月 |
深圳市出台了《细胞制备中心建设及管理规范》 |
| 2016年10月 |
上海市也出台了《临床细胞治疗技术平台设置基本要求》 |
| 发布时间 |
管理细则与标准 |
| 2016年末 |
卫计委发布第一个征求意见稿,确定CAR-T治疗产品将以药物开发进行监管 |
| 2017年5月22日 |
科技部官网发布了《关于对国家重点研发计划干细胞及转化研究等6个重点专项2018年度项目申报指南征求意见的通知》 |
| 2017年6月6日 |
国家科技部和卫计委员等六部委又联合印发《“十三五”卫生与健康科技创新专项规划》 |
| 2017年12月22日 |
卫计委发布《细胞治疗产品研究与评价技术指导原则(试行)》,为我国细胞治疗产品研发与生产提供了更加规范、可控的标准 |
国内CAR-T临床研究随着行业监管指导原则的细化与完善,也将逐渐落地生根。按照新的指导原则,自2017年底起,截至2018年5月初,获国家食品药品监督管理局药品评审中心(CDE)受理的一共有8 家公司、14项CAR-T产品。其中11项靶向CD19靶点、2项靶向BCMA、1项靶向GPC-3治疗。
目前,有关细胞治疗的具体管理细则与标准也越来越细化,这就意味着未来细胞治疗产品都将按照新药进行严格监管和审批。目前,我国干细胞治疗和肿瘤免疫细胞治疗的临床研究,从数量上来看均处于国际领先水平,并处于蓬勃发展之势。

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。