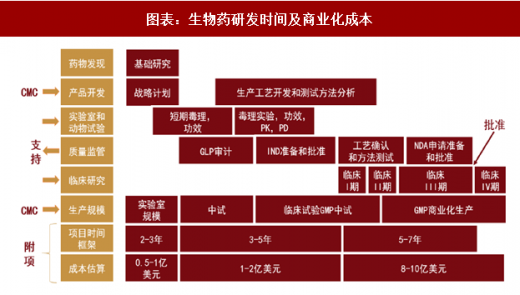
生物药研发生产主要包括药物发现、临床前研究、临床试验和商业化生产等阶段。从药物发现开始,到临床研究申请(IND)前,大概需要 3-6 年,期间要完成临床前研究,包括工艺开发、技术转移和制造生产三个步骤。IND 审核批准通过后,可以进行临床试验,临床试验一般至少需要进行 I、II、III 三期,这个阶段需要 6-7 年,在临床试验成功后可向 FDA 提交生物制品上市许可申请(BLA)。FDA 受理申请文件后,需要进行生物制品上市许可申请批准前检查(PAI),审核通过后,药品可以开始生产上市,这一阶段大概需要 0.5-2 年。生物药研发整个流程下来平均需要消耗 9.5-15 年的时间,其时间成本、人力物力的投入都是巨大的。
一、壁垒 1:发现与制备,转基因小鼠平台 Vs 噬菌体展示技术
以目前最为火热的抗体药为例,目前人源抗体的制备主要包括两项技术:转基因小鼠技术和噬菌体展示技术。
转基因小鼠平台:具有高特异性、高亲和力等特点,能大大减少潜在的免疫源性,但是其研发投入大、周期长,也带来一定的局限性。
噬菌体展示技术:具有快捷、准确、不受氨基酸位点限制、库容量大等特点,能够模拟天然表位的结构和功能,免疫源性好,生产成本相对低廉,但是该技术仍存在一定的不足之处,容易受到密码子表达偏好性、转化效率、阳性克隆等影响。

1、人源化转基因小鼠平台
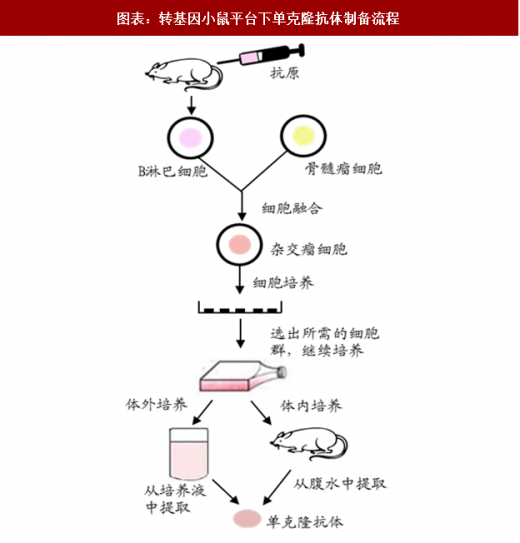
随着单克隆抗体杂交瘤技术的建立,人们在鼠源抗体的基础上逐渐开发出了更具人源亲和性的全人源抗体,转基因小鼠就是生产全人源抗体的一个重要平台。截至2015年12月底, FDA 已批准上市 12 种通过转基因小鼠平台技术开发的全人源单抗,如安进的 evolocumab
(antiPCSK9)、nivolumab(anti-PD-1) 和 denosumab(anti-RANKL)等,以及常用靶点升级抗体药物 panitumumab(anti-EGFR)、canakinumab(anti-IL-1β)和 ofatumumab
(anti-CD20)等。
转基因小鼠在人源抗体药物的研发上具有自身优势,转入小鼠的人免疫球蛋白基因在小鼠的免疫系统中可进行天然抗体的选择机制和成熟机制,使得产生的抗体具备成为药物的天然优势。转基因小鼠平台可通过杂交瘤制备全人源单抗,用于前期的药物研究。目前主要有三大转基因小鼠平台:
Medarex 公司的 HuMAb-Mouse:目前已被授权给多家药企使用,从而利用该技术完成了众多靶点的全人源单抗研发。
Abgenix 公司的 XenoMouse:2005 年,XenoMouse 技术被 Amgen 公司花费22亿美元从Abgenix公司收购,利用这一平台生产的产品包括Vectibix等。
Regeneron 公司的 Veloclmmune mouse:新一代的转基因小鼠技术平台,该平台不再仅仅可以产生完整的全人源单抗,还可以产生多样化、高质量、特异性强的全人源单抗可变区,这些可变区的编码 DNA 可与任何给定的人源恒定区序列进行连接,从而按照预想的方向设计抗体分子,代表产品包括Dupixent 等。
另外还有日本协和发酵麒麟的 TC Mouse 和 KM Mouse,以及 Open Monoclonal Technology(OMT)的 OmniMouse,该平台已被药明生物和金斯瑞科技采用。
2、噬菌体展示技术
噬菌体展示技术是制备人源抗体、小分子抗体和其它各类抗体的另一重要平台,这一技术是应用最广泛的体外抗体筛选技术。产品包括英国 Cambridge Antibody Technology 公司(现属于 AstraZeneca 公司)的 Adalimumab 等。Adalimumab 后被艾伯维公司的购得,商品名为 Humira (修美乐),2017 年其销售额高达 184 亿美元。
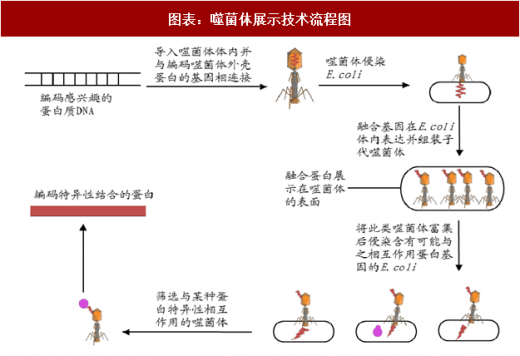
该技术的基本原理是采用生物学手段,在噬菌体基因组中插入抗体基因片段,使噬菌体外壳蛋白表面能够融合表达抗体片段,实现了抗体基因型和表现型的统一,即可用于筛选,也可再次感染宿主菌进行扩增。其中每个噬菌体展示一种抗体,这些重组噬菌体的集合称作噬菌体抗体库,可以方便的用来抗体高通量筛选。从人 B 淋巴细胞中扩增抗体基因,可用来构建人源噬菌体抗体库用于抗体筛选。
噬菌体展示技术能够克服免疫耐受,在制备靶向肿瘤、自身抗原、毒性抗原、高度保守的抗原等抗体中具有很大的优势,同时也可采用细胞、组织作为抗原甚至在生物体内筛选抗体,应用广泛,并且筛选效率高。
二、壁垒
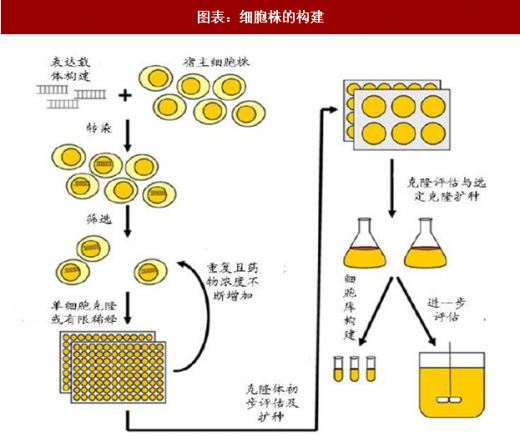
2:生物药的表达基础——细胞株的构建
目前,体外重组蛋白的生产主要包括两大系统:原核细胞蛋白表达和真核细胞蛋白表达。不同的表达系统所生产的蛋白在活性和应用方法方面均有所不同。

1、原核细胞表达系统
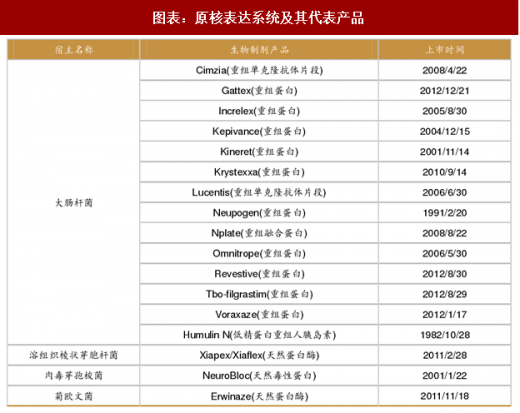
原核表达系统主要包括大肠杆菌表达系统、乳酸球菌表达系统、芽孢杆菌表达系统这三类。但是原核表达系统的最大问题在于外源蛋白转录后缺乏糖基化和磷酸化修饰,并且原核表达的蛋白无法形成复杂二硫键。当然原核表达也有很多优点:
大肠杆菌:属于革兰氏阴性菌,遗传背景清晰,繁殖速度快,成本低且表达量高。多用于目标蛋白分子量小于 100kD,且翻译后修饰作用不影响特定结构和生物活性的蛋白表达。大肠杆菌是目前最常用的原核表达系统,市场上销售的大约 30%的重组蛋白产品由大肠杆菌生产,例如部分胰岛素和人生长激素。全球胰岛素市场在 2014 年的规模就已经达到了 140 亿美元,预计我国 2020 年的胰岛素市场可达到 760 亿元。代表产品如法国礼来公司(Eli Lilly and Company)的优泌林(Humulin),2017 年上半年销售额 6.72 亿美元。
参考观研天下发布《2018年中国生物药品行业分析报告-市场深度分析与发展前景研究》
乳酸菌:属于革兰氏阳性菌,膜单一,主要用于大量膜蛋白的表达。
芽孢杆菌:属于革兰氏阳性菌,它能表达并分泌外源蛋白到培养基中,适合分泌型蛋白的生产,如细胞因子或需要形成复杂二硫键的外源蛋白。利用芽孢杆菌表达的外源蛋白包括白细胞介素、人表皮生长因子(hEGF)、胰岛素原等。
2、真核细胞表达系统
真核细胞表达系统主要包括酵母表达系统、昆虫细胞表达系统、哺乳动物细胞表达系统这三类,此节重点介绍前两类,哺乳动物细胞表达系统在下面的章节详细介绍。
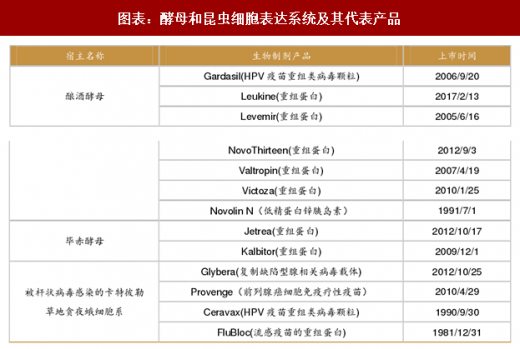
酵母表达系统:酵母中表达的外源蛋白可以进行翻译后修饰,如磷酸化和糖基化。用于外源蛋白表达的酵母菌株包括酿酒酵母、粟酒裂殖酵母、毕赤酵母和乳酸克鲁维酵母。酿酒酵母生产的重组蛋白包括人胰岛素、胰高血糖素、水蛭素类似物、尿酸氧化酶、血小板衍生生长因子等。代表产品如诺和诺德公司生产的诺和灵(胰岛素)系列产品。
昆虫细胞表达系统:可以实现膜蛋白和蛋白激酶的表达。在大多数昆虫细胞表达系统中,外源基因通过杆状病毒载体转染宿主细胞,从而将目标基因通过同源重组插入到宿主的基因组中。昆虫细胞来源的获批药物包括:葛兰素史克的宫颈癌疫苗 Cervarix、Valeant 的前列腺癌治疗疫苗 Provenge 和 Protein Science 的流感疫苗
Flublok 等。
3、哺乳动物细胞表达系统
目前,哺乳动物细胞表达已成为生物药生产特别是抗体药生产最重要的技术。与酵母等其它真核细胞系相比,哺乳动物细胞表达外源蛋白的优势在于可表达含有复杂二硫键或翻译后修饰的靶蛋白,且蛋白可分泌到培养液中,其产物蛋白的糖基化程度高且均一,有效提高药效,同时减少药物副作用。
中国仓鼠卵巢细胞(CHO)是目前重组蛋白生产领域最具代表性的工程细胞,其具有高效扩增和表达的特点,在补料培养中可达到 1-10g/L。据统计,使用 CHO 细胞系作为表达载体开发的抗体药物超过 60%。CHO 细胞从 1957 年被首次分离,目前已驯化出多种商业化细胞系,包括 CHO-K1、CHO-S 等。
CHO-K1SV 细胞:为龙沙训化的第一代的 CHO-K1 细胞系,应用最广泛,已有 29种该系统生产的药物获批上市,如罗氏的 Zenapax、Medlmmune 的 Synagis 等;
CHO-S 细胞是通过驯化筛选生长速度快的 CHO 细胞得到的,商品化细胞系以赛默飞世尔的 CHO-S 为代表。
目前,越来越多的工程改造细胞系被用于提高药物的质量和产率,如使用 ZFNs、TALEN、CRISPR 等基因组编辑技术对 CHO 细胞系的基因进行改造。
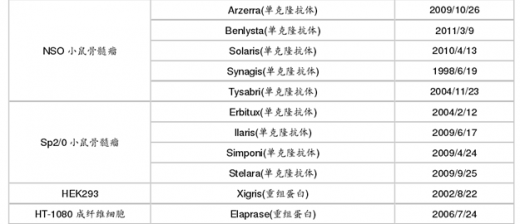
其它主要哺乳动物细胞系包括 HEK293(人胚肾细胞)、HT-1080(人纤维肉瘤细胞)、BHK(乳仓鼠肾细胞)细胞系。
HT-1080 细胞: Agalsidase alfa, Epoetin delta (DYNEPO), Idursulfase (ELAPRASE) 和 Velaglucerase alfa (VPRIV)等。
HEK293 细胞:百健开发的长效八因子 Eloctate、长效九因子 Alprolix 以及Octapharma 开发的八因子产品 Nuwiq 和礼来的 GLP-1 产品 Trulicity(度拉鲁肽)。
BHK 细胞:常用来表达疫苗产品,用此细胞系表达的上市糖蛋白药物还包括诺和诺德的七因子 NovoSeven、拜耳的八因子 Kogenate 和百特的猪八因子 Obizur。


三、壁垒
3:生物药的生产
生物制品生产工艺的开发过程一般需要经历工程细胞库的构建、摇瓶工艺开发、小试工艺开发、中试放大、生产纯化和制剂等步骤。细胞库通常是三级管理,即原始细胞库(PCB)、主细胞库(MCB)和工作细胞库,其中 MCB 和 WCB 需要检定合格后并分别于 GMP 环境下存放。另外,根据生物制剂的属性特点不同,会采用不同的哺乳动物细胞进行生产,其中 BHK21、
CHO 细胞等传代细胞系已证明具有致瘤性,可不必做致瘤性检测;而 Vero 细胞因其在一定代次内无致瘤性,则必须做致瘤性检测。

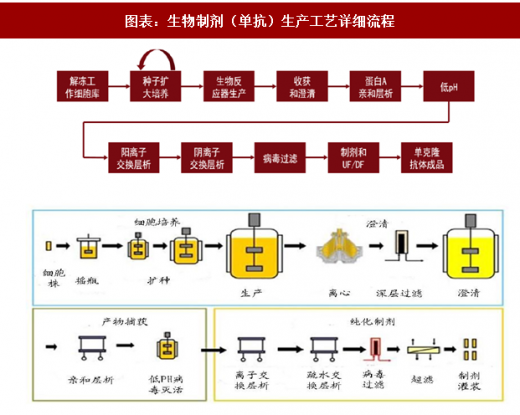
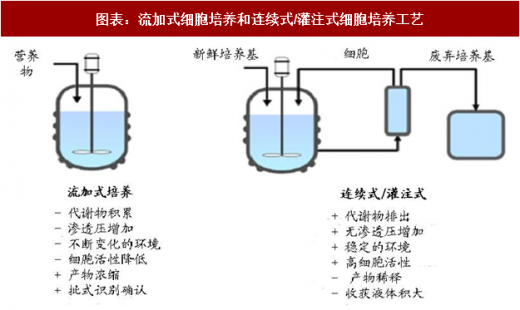
生物药的生产工艺主要包括流加式培养和连续式培养
流加式培养
流加式培养(Fed-batch,又称为“补料分批培养”)在过去的几十年里,是生物制药行业进行细胞培养制备生物药最常用的方式。该方法在实现高表达方面取得了巨大的进步,形成了一整套完整的工艺开发和生产体系,其因操作相对简单,易于监控和产品检测和放行等特点,绝大多数企业均采用 fed-batch 作为其药品生产的操作方式。
流加培养是当前重组蛋白生产的主流培养模式。流加式操作主要是根据细胞对营养物质的不断消耗和需求,连续或半连续的流加浓缩营养物,使细胞持续高密度的生长,提高单位反应器体积内目的蛋白产量,从而达到高效生产的目的。流加培养工艺的关键技术主要包括细胞代谢的调控、培养基的优化设计、流加策略的选择及优化。
目前国际上主流抗体药物的生产工艺为流加培养,建造规模已达万升级。流加培养工艺操作相对简便,可重复性强,较连续灌注模式减少了较多的操作环节,降低了污染的机会,有利于产品批次间的稳定性和过程成本的控制。但流加培养模式最大的缺点是产能受限于发酵罐的尺寸,为了提高产能只有建造更大的发酵罐。
连续式/灌注式细胞培养
除了传统的流加式培养,现在有些公司开发了另一种连续流工艺培养模式,也称灌流培养模式。灌流式培养是把细胞和培养基一起加入反应器后,在细胞增长和产物形成过程中,不断地将部分培养基取出,同时又连续不断地灌注新的培养基。在灌注培养中,细胞保留在反应器系统中,收获培养液的同时不断地加入新鲜的培养基。
灌注培养的主要优点是使用更小的设备表达更多产物和有效改善产品质量,同时补料营养成分连续加入,有害代谢产物得以及时去除,细胞在生长过程中能够长时间维持高密度培养和存活率,表达产物具备高度一致性。当反应体系内表达的是易降解或者半衰期很短的产品时,灌注的优势尤为明显。培养环境的优化、体系的精确稳定控制、细胞培养基的开发以及微膜过滤细胞截留设备的发展也进一步推动了连续灌注工艺的发展。该工艺的缺点是产物稀释与收获液体积大。
目前已经有多个使用灌流工艺进行培养的上市产品,如凝血因子(FVIII 产品: Kogenate,拜耳; Refacto,辉瑞;FVII 产品:Novoseven,诺和诺德),Protein C(Xigris,礼来)及其他的酶制剂甚至包括一些单抗产品(Reopro 和 Remicade,强生;Simulect,诺华)。
连续灌注培养又分为浓缩分批补料和灌注培养两种方式,其主要区别在于截留设备截留的分子量大小。浓缩分批补料的主要目的是在相对短的时间内,通过高细胞密度和活率的维持实现产物高表达,通常用于表达单抗等稳定蛋白的产品,因为它们不会随着培养时间的增加(20-30 天)而出现降解等产品质量方面的问题。对于灌注生产而言,目标蛋白会持续通过截留设备流出到反应体系之外,因此可以保证蛋白持续收获纯化,通常用于表达不稳定的融合蛋白和细胞因子等产品。


【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。