

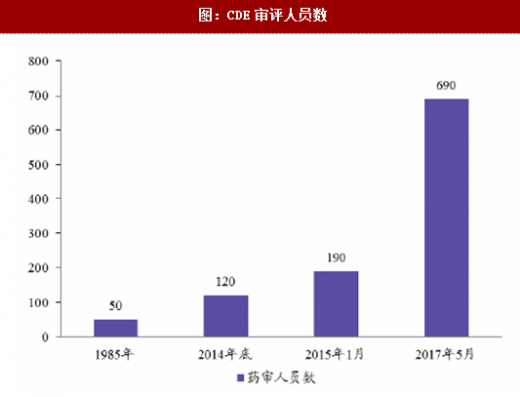
总局很早就意识到了药审人员数量少、待遇低的问题,自2014年10月起扩充审评技术力量,经过多次招聘,到2017年中期已经将药审队伍扩充到690人以上,预计到2017年底将达到1000人,缓解了审评积压。总局还从省局借调、培训了部分审评人员来总局承担部分审评任务。此外CDE也采取集中审评以增进审评效率:积压的同品种实行集中审评。对已经受理的相同品种,按照统一的审评标准和尺度组织力量进行集中审评。
临床试验数据核查常态化,震慑低水平申报
722事件”开启药物临床试验数据自查核查大幕,减少积压:针对企业低水平重复申报,部分注册申报的临床数据不真实,不完整、不规范的问题,CFDA于巧年7月22日发布《总局关于开展药物临床试验数据自查核查工作的公告》,针对包括进口、仿制药和新药共1622个受理号的待审药品要求其进行自查,确保临床试验数据真实、可靠,相关证据保存完整。《公告》规定:
1.2015年8月25日前,申请人应就附件列出的品种,向国家食品药品监督管理总局食品药品审核查验中心提交电子版自查报告、临床试验合同扫描件、研究团队主要人员情况等材料,以及法定代表人签字的真实性承诺;
2. 申请人自查发现临床试验数据存在不真实、不完整等问题的,可以在2015年8月25日前向国家食品药品监督管理总局提出撤回注册申请。
3.将组织专家对申请人的自查材料等进行数据分析并视情况开展飞行检查;对核查中发现临床试验数据真实性存在问题的申请人、临床试验机构、合同研究组织以及相关责任人员分布有所惩处
这次临床试验数据自查核查活动政策出台急促、涉及范围广、标准严、要求高,对行业震动很大,最终选择撤回的受理号达到1210种,占比约75%,不仅针对本批次待审品种起到清理作用,也对后继的申报品种有效震慑,提升了申报质量。其后CFDA陆续发布了一系列后续规定,对核查要点、工作程序、发现问题的处理措施和撤回品种重新申报等细节予以详细的制度保障安排。

722事件后自查核查常态化:自722事件至今(17年11月末)的两年多中CFDA又开展药物临床试验数据自查核查9次,与首批自查核查一起共包含注册申请2158个。其中,据CFDA所公布的17年6月之前的自查核查结果看,撤回数量共1316个,占可比总数的比重高达“%,有效减少质量较差的待审任务。另一方面,每一批次的撤回比例不断降低,也可显示自查核查常态化对于注册申报的震慑力量,不真实、不完整、水平低下的申报已经被药企主动消除。
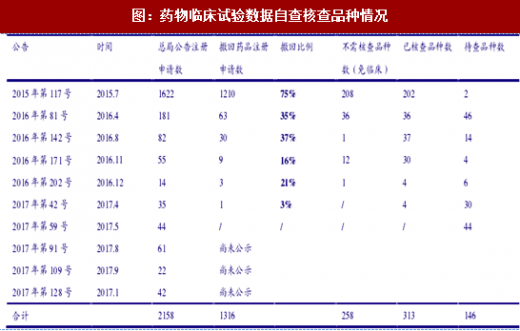
从已核查结果看,在已核查的313个药品注册申请中,有38个注册申请的临床试验数据涉嫌数据造假,其中新药注册申请16个,仿制药注册申请17个,进口药注册申请5个。考虑到这是在已经撤回了一大半之后仍有12%的注册存在问题,核查标准之严格可以想见。核查中发现的问题主要包括临床试验过程记录及临床检查化验等数据溯源、方案违背和试验用药品管理过程与记录方面。

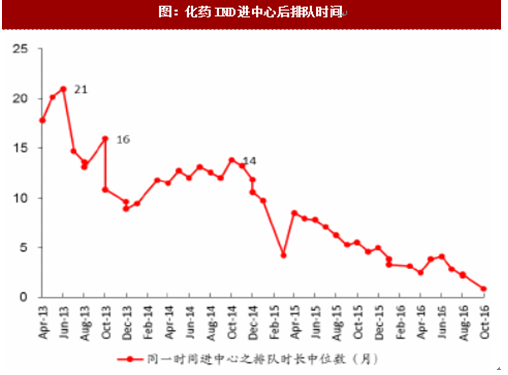
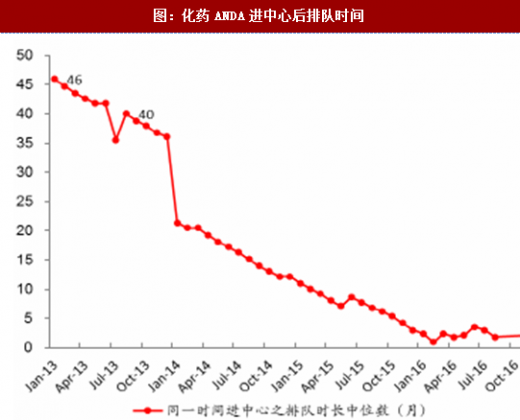
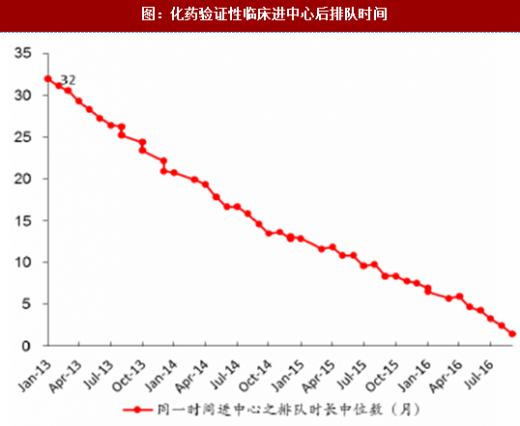
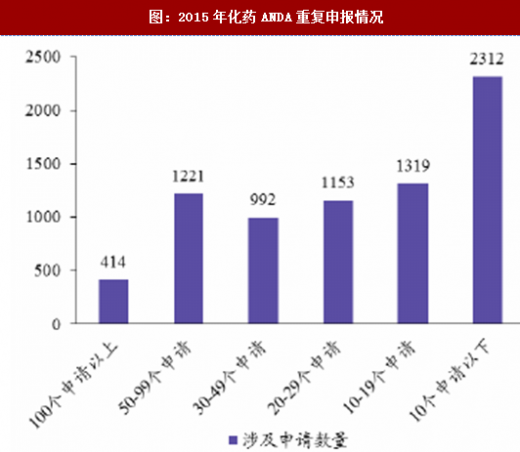
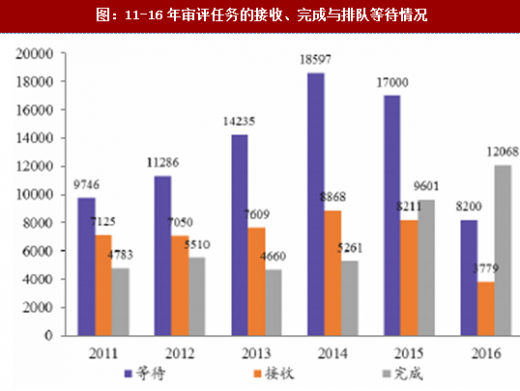
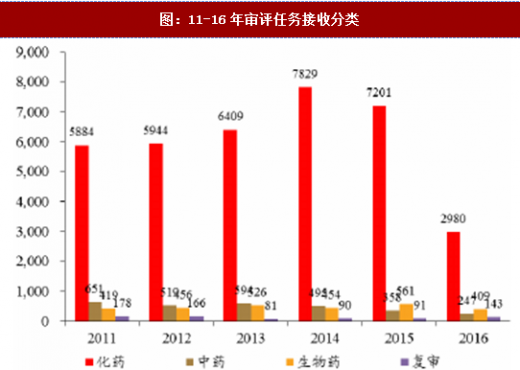
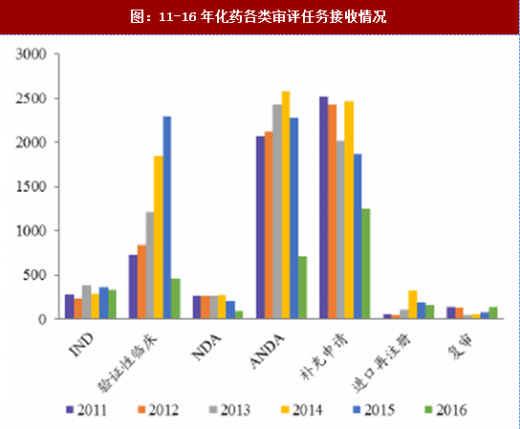
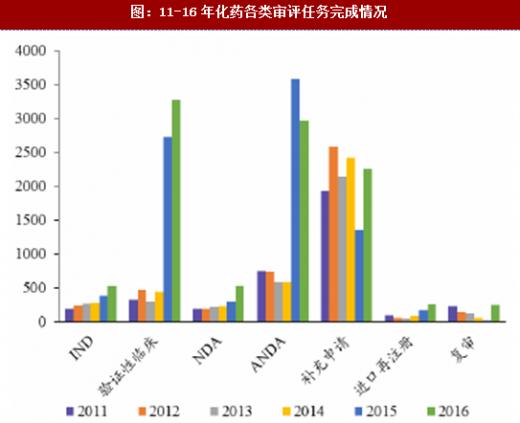
通过增加药审人员、临床试验数据自查核查和集中审评等一系列措施,审评任务积压排队现象明显缓解,积压基本得到解除。2015年,审评任务完成数量超过接收数量,为近年来之首次,年末排队待审任务较14年末降低1500个以上;2016年,接收任务进一步减少,完成数量继续快速上升,导致排队待审任务减少至8200个;到17年8月,待审任务已减少到5000件,积压基本解除。分审评通道类别看,15年ANDA接收量有所减少,16年ANDA和验证性临床的接收量均大幅减少,反映了临床试验自查核查和总局其他不鼓励大量重复仿制药的政策(包括一致性评价等)的震慑效果;ANDA和验证性临床作为集中审评重点而被大规模完成审评,因此这两个通道的排队现象明显改观。仿制药堰塞湖的疏通也使其他审评通道变的更为顺畅,IND和NDA的排队等待时长亦大幅下降,对新药能更快速进入审评审批构成利好。

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。