药物种类 |
常规化疗药物 |
小分子靶向药 |
单抗药物 |
ADC药物 |
特异性 |
低 |
高 |
大 |
高 |
副作用 |
大 |
较小 |
较小 |
明显 |
给药方式 |
口服 |
口服 |
静脉注射 |
静脉注射 |
肿瘤细胞耐药性 |
强 |
较强 |
相对较弱 |
较强 |
研发难度 |
大 |
大 |
相对较小 |
大 |
ADC药物的工艺技术壁垒高,发展至今,也经过三代技术的更迭。第三代ADC药物通过小分子药物与单克隆抗体的位点特性行结合,产生DAR为2或4的ADC,从而降低药物毒性,减少未结合的抗体,提高药物的稳定性和药代动力学效率,代表药物有Polivy(已上市),Vadastuximab Talirine、IMGN779 和 MEDI4276等陆续进入到不同临床阶段。
|
第一代ADC |
第二代ADC |
第三代ADC |
抗体 |
鼠源单抗、嵌合单抗 |
人源化单抗 |
人源单抗 |
连接子 |
不可降解,连接不稳定 |
可切割、不可切割 |
改进后的多种连接子 |
偶联药物 |
长春碱、阿霉素 |
MMAE、MMAF、DM1、DM4 |
改进后更多差异化药物 |
偶联位点 |
DAR不可控 |
DAR:4-8 |
DAR:2-4 |
主要方法:Thiomab 技术、ThioBridge 技术、非天然氨基酸法、酶催化法 |
|||
代表药物 |
Mylotarg |
Kadcyla、Adcetris、Besponsa |
Polivy |
相较上一代优点 |
/ |
靶向性/结合力提升;更强药效的药物;更低免疫原性 |
毒性降低;CMC稳定性高;半衰期延长;动力学改进;药物活性高,低抗原水平下的细胞活性高 |
缺点 |
药效不足;毒性/副作用强;免疫原性强;半衰期短 |
毒性/副作用较强;存在耐药现象;DAR均一性不强,影响CMC及临床治疗窗口(毒性与) |
脱靶效应仍然存在;可开发靶点选择;抗体内化效率;潜在的耐药问题 |
近年来,全球掀起ADC药物研发的热潮,目前全球已获批上市ADC药物共11款,其中国内已上市2款(Kadcyla和Adcetris)。
序号 |
商品名 |
通用名 |
靶点 |
抗体类型 |
偶联药物 |
公司 |
全球首次获批时间 |
1 |
Mylotarg |
Gemtuzumab ozogamicin 吉妥珠单抗奥佐米星 |
CD33 |
人源化IgG4 |
卡其霉素(DNA损伤剂) |
辉瑞 |
2000(2017 年重新上市) |
2 |
Adcetris |
Brentuximab vedotin 本妥昔单抗 |
CD30 |
嵌合 IgG1 |
单甲基奥斯他汀E(微管抑制剂) |
武田 |
2011 |
3 |
Kadcyla (T-DM1) |
Trastuzumab emtansine 恩美曲妥珠单抗 |
HER2 |
人源化IgG1 |
DM1(拓扑异构酶抑制剂) |
基因泰克,罗氏 |
2013 |
4 |
Besponsa |
Inotuzumab ozogamicin 奥英妥珠单抗 |
CD22 |
人源化IgG1 |
卡其霉素(DNA合成抑制剂) |
辉瑞 |
2017 |
5 |
Lumoxiti |
MoxetumomabPasudotox-tdfk 帕西妥莫单抗 |
CD22 |
嵌合 IgG1 |
绿脓杆菌外毒素 |
阿斯利康 |
2018 |
6 |
Polivy |
Polatuzumab vedotin- piiq 泊洛妥珠单抗 |
CD79b |
人源化IgG1 |
单甲基奥斯他汀E(微管抑制剂) |
基因泰克,罗氏 |
2019 |
7 |
Padcev |
Enfortumab vedotin |
Nectin-4 |
人源化IgG1 |
单甲基奥斯他汀E(微管抑制剂) |
Astellas SeattleGenetics |
2019 |
8 |
Enhertu |
Trastuzumab deruxtecan 曲妥珠单抗重组 |
HER2 |
人源化IgG1 |
DXd(拓扑异构酶抑制剂) |
阿斯利康第一三共 |
2019 |
9 |
Trodelvy |
Sacituzumab govitecan |
TROP-2 |
人源化IgG1 |
SN-38 |
Immunomedics |
2020 |
10 |
Blenrep |
Belantamab mafodotin |
BCMA |
人源化IgG1 |
单甲基奥斯他汀F(微管抑制剂) |
GSK |
2020 |
11 |
Akalux |
Cetuximab saratolacan |
EGFR |
人源化IgG1 |
IRDye700DX |
乐天医药 |
2020 |
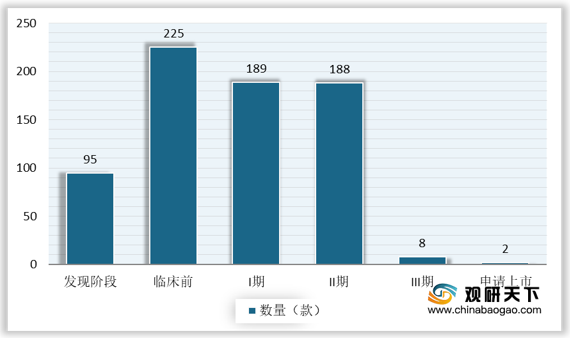
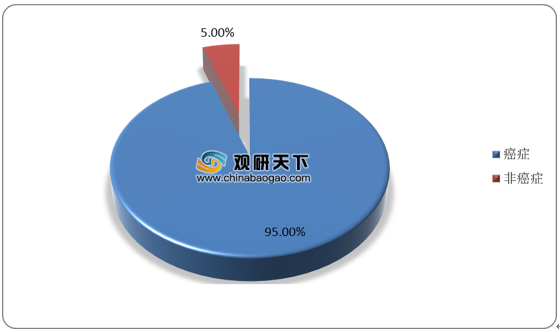
根据数据,截至2020年7月,全球ADC研发药物中约 95%产品处于临床早期阶段,仅有8款处于临床3期、2 款ADC 药物处于申请上市阶段。现阶段处于临床阶段的ADC药物以癌症为主要适应症,全球在研ADC药物靶点排名前五(按在研数量计)分别为HER2、EGFR、TROP-2、PSMA和CD19。
ADC抗体偶联成为国内外新研发热点,因此在国外大型制药企业投资ADC研发领域的同时,国内药企也纷纷在ADC研发领域布局。目前国内上市的ADC药物仅有罗氏的KADCYLA以及武田制药的ADCETRIS,ADC研发实力相较国外制药巨头仍有不少差距,尚在追赶期。我国ADC药物研发较为领先的企业包括荣昌生物、百奥泰、东曜药业等,研发进展较快的有百奧泰的BAT8001和东曜的TAA013,已经处于临床3期阶段。
公司 |
ADC 药物 |
靶点 |
开发阶段 |
荣昌生物 |
RC48 |
HER2 |
NDA |
RC88 |
Mesothelin |
I期 |
|
RC108 |
C-MET |
IND |
|
RC118 |
未披露 |
IND |
|
百奥泰 |
BAT8001 |
HER2 |
III期 |
BAT8003 |
TROP-2 |
I期 |
|
东曜药业 |
TAA-013 |
HER2 |
III期 |
浙江医药 |
ARX788 |
HER2 |
Phase II/III |
ARX305 |
CD70 |
临床前 |
|
云顶新耀 |
Trodelvy |
TROP-2 |
FDA已上市;国内Phase IIb |
科伦药业 |
A166 |
HER2 |
I期(中美双报) |
SKB264 |
TROP-2 |
I期(中美双报) |
|
恒瑞医药 |
SHR-1201 |
HER2 |
I期 |
SHR-A1811 |
HER2 |
I期 |
|
SHR-1403 |
c-Met |
I期 |
|
复星医药 |
FS-1502 |
HER2 |
I期 |
石药集团 |
DP303c |
HER2 |
I期(中美双报) |
复旦张江 |
抗CD30抗体交联 |
CD30 |
I期 |
TROP-2抗体偶联药物 |
TROP-2 |
临床前研究 |
|
抗HER2抗体偶联药物 |
HER2 |
临床前研究 |
|
齐鲁制药 |
人源化HER2单抗-DM1 |
HER2 |
Phase I |
Vicineum |
EpCAM |
美国PhaseIII;中国临床前 |
|
上海美雅珂 |
MRG001 |
CD20 |
I期 |
MRG002 |
HER2 |
I期 |
|
MRG003 |
EGFR |
I期 |
|
MRG004-009 |
未披露 |
3个临床前研究;3个基础研究 |
|
多禧生物 |
DX126-262 |
HER2 |
Phase I(中美双报) |
DAC-002/JS108 |
TROP-2 |
I期 |
|
DAC-003 |
未披露 |
临床前研究 |
|
DAC-004 |
未披露 |
临床前研究 |
|
启德医药 |
HER |
HER2 |
中美双报Phase I |
特瑞思 |
TRS005 |
CD20 |
I期 |
嘉和生物 |
GB251 |
HER2 |
IND |
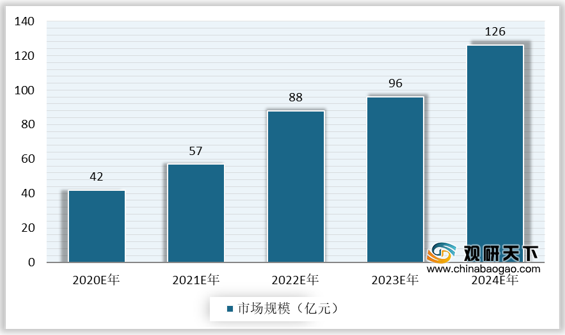
伴随ADC技术的不断迭代和成熟,治疗效果和作用力持续上升,并且ADC药物研发进展迅速,市场容量将持续扩大。根据预测数据,中国ADC药物行业市场规模由2020年的42亿元增长至2024年的126亿元人民币,年复合增长率高达31.6%。


【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。