1)明确评价对象和时限。化学药品新注册分类实施前批准上市的仿制药,凡未按照与原研药品质量和疗效一致原则审批的,均须开展一致性评价。国家基本药物目录(2012年版)中2007年10月1日前批准上市的化学药品仿制药口服固体制剂,应在2018年底前完成一致性评价,其中需开展临床有效性试验和存在特殊情形的品种,应在2021年底前完成一致性评价;逾期未完成的,不予再注册。化学药品新注册分类实施前批准上市的其他仿制药,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价;逾期未完成的,不予再注册。
2)确定参比制剂遴选原则。参比制剂原则上首选原研药品,也可以选用国际公认的同种药品。药品生产企业可自行选择参比制剂,报食品药品监管总局备案;食品药品监管总局在规定期限内未提出异议的,药品生产企业即可开展相关研究工作。
3)选用合理选用评价方法。药品生产企业原则上应采用体内生物等效性试验的方法进行一致性评价。符合豁免生物等效性试验原则的品种,允许药品生产企业采取体外溶出度试验的方法进行一致性评价。
4)鼓励企业开展一致性评价工作。通过一致性评价的药品品种,由食品药品监管总局向社会公布。药品生产企业可在药品说明书、标签中予以标注;开展药品上市许可持有人制度试点区域的企业,可以申报作为该品种药品的上市许可持有人,委托其他药品生产企业生产,并承担上市后的相关法律责任。通过一致性评价的药品品种,在医保支付方面予以适当支持,医疗机构应优先采购并在临床中优先选用。同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种。通过一致性评价药品生产企业的技术改造,在符合有关条件的情况下,可以申请中央基建投资、产业基金等资金支持。
5)对于美欧日共线生产品种的一致性评价给予说明。国内药品生产企业已在欧盟、美国和日本获准上市的仿制药,可以国外注册申报的相关资料为基础,按照化学药品新注册分类申报药品上市,批准上市后视同通过一致性评价;在中国境内用同一生产线生产上市并在欧盟、美国和日本获准上市的药品,视同通过一致性评价。
国办发{2016}8号文的发布真正起到了统领全局作用,各环节相关政策开始有序推进,随后CFDA对一致性评价工作各环节进行了优化调整,旨在保障受理、检查、检验和审评等环节顺畅衔接,保障评价标准统一:
1)参比制剂备案与推荐程序逐渐完善:CFDA发布的供企业选择参比制剂时参考清单分为已在中国境内上市和未在中国境内上市两类,建议企业按以下顺序选择其一作为参比制剂备案:(一)原研药品:进口原研药品、经审核确定的原研企业在中国境内生产上市的药品、未进口原研药品;(二)在原研企业停止生产的情况下,可选择美国、日本或欧盟获准上市并获得参比制剂地位的药品。参比制剂的确定一般首先由仿制药企业自行选择并报国家一致性评价办公室备案,60个工作日内无异议,即可以此备案试剂为参比试剂开始试验。一致性办公室会组织专家就备案、推荐和主动申报的参比制剂审核确定并及时公布。原则上,企业应当以CFDA公布的参比制剂为准,对CFDA已公布的参比制剂,建议企业按照公布的参比制剂开展研究,未备案的无需再备案。
其中,为了便于企业开展研究工作,总局统计了前8批610个品种规格的参比制剂情况,包括《2018年底前须完成仿制药一致性评价品种目录》中的163个品种(219个品规),该目录中另约有90左右品种为改规格、改剂型、改盐基的品种,按照2月份发布的《仿制药质量与疗效一致性评价工作中改规格药品(口服固体制剂)评价一般考虑》《仿制药质量与疗效一致性评价工作中改剂型药品(口服固体制剂)评价一般考虑》《仿制药质量与疗效一致性评价工作中改盐基药品评价一般考虑》等技术指南,上述改规格、改剂型、改盐基的约左右品种的参比制剂选择依据也已明确。截止目前,总局共发布10批仿制药参比制剂目录(一般单批次为289目录参比制剂,双批次为非289目录参比制剂)。从各月参比制剂数量来看,前六批数量基本保持平稳,第八批和第十批显著增多,为了推动仿制药一致性评价顺利推进总局也在加快公布参比制剂。与此同时,截止10月20日参比制剂备案条目共计5910个。
参考观研天下发布《2018-2023年中国医药产业市场竞争态势调查与未来发展方向研究报告》
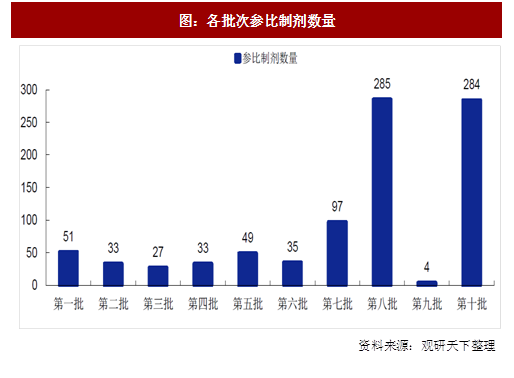
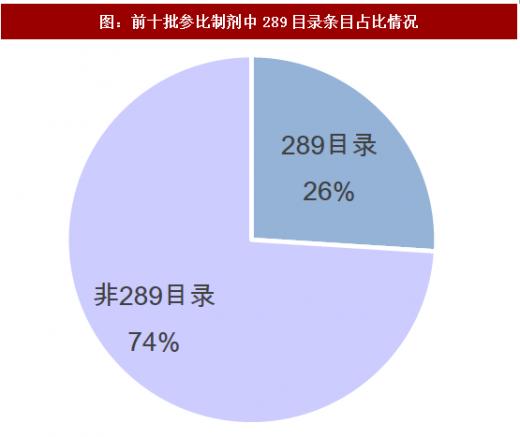
前十批参比制剂中,非289目录品种占比明显高于289目录品种,其占比高达74%。截止目前,289目录合计235条目,非289目录663条目(包含68个289目录品种的其他规格)。截止目前,共有162个289目录的品种公布了参比制剂(相较于总局对前八批统计数量少的原因是剔除了289目录品总的其他规格),仅占比56%,因此我们判断2018年底之前289目录品种全部完成一致性评价的可能性很小,优选品种做一致性评价是各相关仿制药企业的明智之选。
关于参比制剂获得事宜,相关政策也给予完善与明确。企业可以通过申报一次性进口申请及进口备案、通关等程序来获得参比制剂,除此之外,企业还可以通过其他方式获得参比制剂,在提交一致性评价资料时,仅需在资料中提供购买凭证、产品包装及说明书等材料,或以其他适当方法证明参比制剂真实性即可。
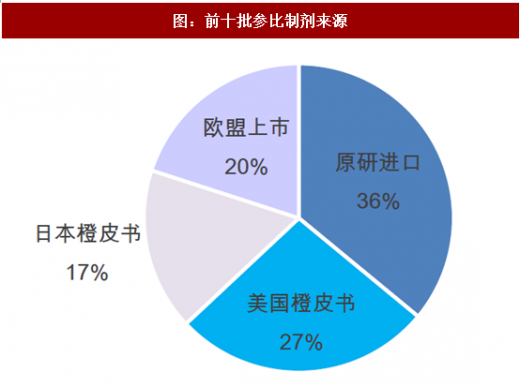
根据前十批公布的参比制剂披露情况,经查询,参比制剂最多来自于原研进口,占比36%;其次是美国橙皮书,占比27%,欧盟上市与日本橙皮书占比分别为20%、17%,这比较符合参比制剂遴选原研进口优先的原则。
2)BE试验开展实行备案制:①仿制药企业开展生物等效性试验前30天,应当在国家食品药品监督管理总局指定的化学药BE试验备案信息平台进行化学药BE试验备案。②申请人在获得备案号后,应在第1例受试者入组前按国家食品药品监督管理总局《关于药物临床试验信息平台的公告》的要求将开展试验的项目、临床试验机构、样本分析机构、参比制剂等信息在国家食品药品监督管理总局药品审评中心药物临床试验登记与信息公示平台登记。③在BE试验完成或因故终止一年内,在备案平台提交BE试验的总结报告或情况说明。④省级食品药品监管部门加强对临床试验机构的日常监管,发现问题及时报告国家食品药品监督管理总局食品药品审核查验中心。

3)生物等效性试验机构实行备案制管理且发布首批豁免或简化BE试验的品种名单,缓解开展临床机构不足问题。此前临床试验机构实行认定制,临床试验机构数量相对较少,不能满足大量仿制药一致性评价需求,且并不是所有的临床试验机构可以承做BE试验,因此临床试验机构成为各家仿制药争夺的稀缺资源。根据《国务院办公厅关于进一步改革完善药品生产流通使用政策的若干意见》(国办发201713号),总局对生物等效性试验机构实行备案制管理。一致性评价中的生物等效性试验可以在现有经认定的临床试验机构进行,也可以在其他具备条件的机构进行。生物等效性试验发起方可以聘请具备评估能力的第三方按《药物临床试验质量管理规范》(GCP)要求对开展生物等效性试验的机构进行评估。
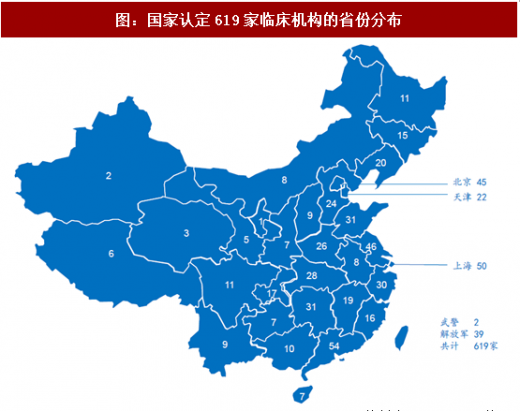
10月26日,国家食药监总局和国家卫计委联合发布《关于药物临床试验机构开展人体生物等效性试验的公告》,发布已经认定具有药物临床试验机构资格的临床机构为619家,数量较去年475家大幅增加。其中,广东、上海、江苏、北京等省份获得认定的临床机构数量较多,随着生物等效性临床机构备案制的执行,后续临床机构数量不足问题将大大缓解。
根据《人体生物等效性试验豁免指导原则》,对于符合豁免原则的品种以及不适合开展人体内研究的品种,国家食品药品监督管理总局可区别情况,分批公布具体豁免BE或简化BE试验的品种目录,以减少不必要的生物等效性试验。

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。